スタチンの種類と一覧による効果比較
スタチンの種類と作用機序:HMG-CoA還元酵素阻害の仕組み
スタチン(HMG-CoA還元酵素阻害薬)は、体内のコレステロール合成経路において重要な酵素であるHMG-CoA還元酵素の働きを阻害することで血中コレステロール値を低下させる薬剤です。この作用機序は1973年に日本の遠藤章らによって発見されました。世界で初めて医薬品として実用化されたのはロバスタチン(商品名:メバコール)で1987年のことでした。
スタチンの作用機序を詳細に見ていくと、単に「肝臓でのコレステロール合成を抑制する」というだけではありません。実際にはより複雑なメカニズムが働いています。
- 肝細胞内でHMG-CoA還元酵素を阻害し、コレステロール合成を抑制
- 肝細胞内のコレステロール濃度が低下
- 肝細胞表面のLDL受容体が増加
- 血液中からLDLコレステロールの取り込みが促進
- 結果として血中LDLコレステロール値が低下
また、スタチンは肝臓でのVLDL(超低密度リポタンパク質)の合成も抑制します。VLDLは体内で中性脂肪(TG)を運搬する役割を持つため、スタチンには副次的にTG値を下げる効果もあります。
スタチンの特筆すべき点は、単に血中脂質値を改善するだけでなく、心筋梗塞や脳血管障害といった動脈硬化性疾患の発症リスクを実際に低下させることが大規模臨床試験で証明されている点です。そのため、脂質異常症治療薬の中でも特に重要な位置づけとなっています。
スタチンの種類と分類:スタンダードとストロングの違い
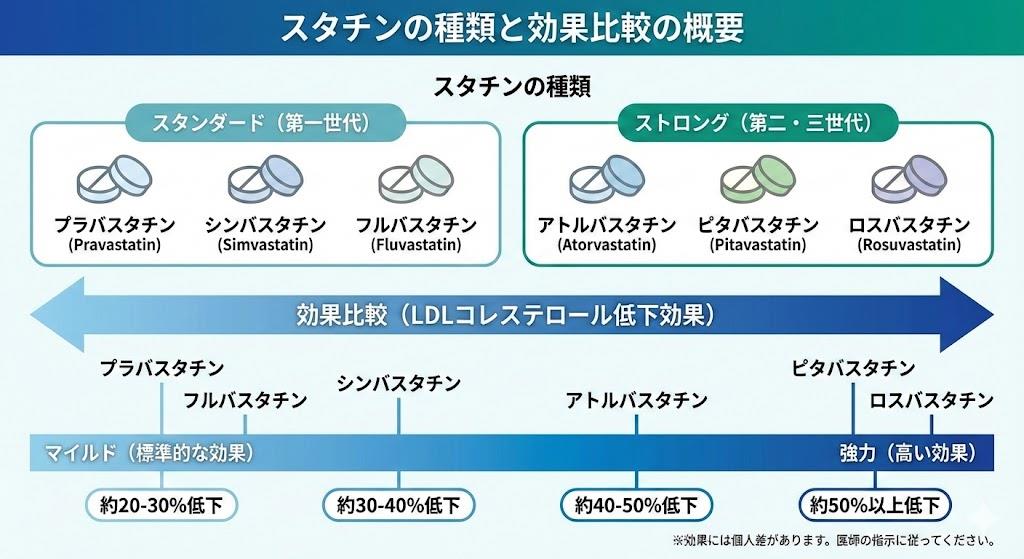
現在日本で使用可能なスタチンは6種類あり、LDLコレステロール低下効果の強さによって「スタンダードスタチン」と「ストロングスタチン」の2つに分類されます。
スタンダードスタチン(LDL低下率:約15-20%)
ストロングスタチン(LDL低下率:約30-40%)
この分類は単に薬効の強さだけを示すものではなく、臨床現場での使い分けの指標となります。処方率を見ると、ストロングスタチンが上位を独占しており、第1位はロスバスタチン(クレストール)、第2位はアトルバスタチン(リピトール)、第3位はピタバスタチン(リバロ)となっています。
スタンダードスタチンは効果がマイルドである一方、副作用リスクが比較的低い傾向があります。特にプラバスタチンは水溶性で肝臓でのCYP代謝を受けないため、「重篤な肝障害のある患者」への禁忌対象外となっている唯一のスタチンです。
一方、ストロングスタチンは強力なLDL低下作用を持ちますが、その分副作用にも注意が必要です。例えばロスバスタチン(クレストール)では、筋肉痛(3.2%)、ALT上昇(1.7%)、CK上昇(1.6%)などが報告されています。
スタチン選択の際には、患者の脂質プロファイル、目標値までの距離、併存疾患、副作用リスクなどを総合的に判断することが重要です。例えば、糖尿病を合併する患者にはピタバスタチン(リバロ)が血糖値を上昇させにくいという特性から選択されることがあります。
スタチンの種類と商品名一覧:主要製剤の詳細比較
日本で使用可能な6種類のスタチンの特徴を詳細に比較します。特に医療現場での処方判断に役立つよう、各製剤の特性を表にまとめました。
| 一般名 | 商品名 | 分類 | 規格 | 脂溶性/水溶性 | 代謝経路 | 特徴 |
|---|---|---|---|---|---|---|
| ロスバスタチン | クレストール | ストロング | 2.5mg, 5mg | 水溶性 | CYP2C9(わずか)、胆汁排泄 | LDL低下効果最強、OD錠あり |
| ピタバスタチン | リバロ | ストロング | 1mg, 2mg, 4mg | 脂溶性 | CYP2C9(わずか)、胆汁排泄 | 血糖上昇作用少なく糖尿病患者に適する |
| アトルバスタチン | リピトール | ストロング | 5mg, 10mg | 脂溶性 | CYP3A4、肝代謝 | グレープフルーツ注意(AUC +146%) |
| プラバスタチン | メバロチン | スタンダード | 5mg, 10mg | 水溶性 | CYP代謝なし、胆汁+腎排泄 | 肝障害患者への使用可能性あり |
| シンバスタチン | リポバス | スタンダード | 5mg, 10mg, 20mg | 脂溶性 | CYP3A4、肝代謝 | グレープフルーツ注意(AUC +1514%) |
| フルバスタチン | ローコール | スタンダード | 10mg, 20mg, 30mg | 脂溶性 | CYP2C9、肝代謝 | 処方量が最も少ない |
処方量のランキングでは、2022年時点で以下の順となっています。
- ロスバスタチン(約10億4000万)
- アトルバスタチン(約8億6400万)
- ピタバスタチン(約4億7300万)
- プラバスタチン(約4億7100万)
- シンバスタチン(約8100万)
- フルバスタチン(約6000万)
特筆すべきは、スタチンとフィブラート系薬剤(ベザフィブラートやフェノフィブラートなど)の併用に関する注意点です。かつては「原則併用禁忌」とされていましたが、2018年10月16日の添付文書改訂により「原則禁忌」の表記が削除されました。ただし、腎機能低下時には定期的な検査が必要で、横紋筋融解症のリスクには引き続き注意が必要です。シンバスタチン(リポバス)については、フィブラート系薬剤との併用時の1日上限が10mgに制限されています。
また、近年ではスタチンと小腸コレステロールトランスポーター阻害剤(エゼチミブ)を組み合わせた配合剤も登場しています。
- ロスーゼット(ロスバスタチン+エゼチミブ)
- アトーゼット(アトルバスタチン+エゼチミブ)
- リバゼブ(ピタバスタチン+エゼチミブ)
これらの配合剤は、異なる作用機序を持つ薬剤を組み合わせることで、副作用を増やさずに相加的な効果が期待できるのが特徴です。
スタチンの種類と副作用:安全性プロファイルと対応策
スタチンは一般的に安全性の高い薬剤ですが、以下のような副作用に注意が必要です。特に医療従事者はこれらを把握し、適切なモニタリングと患者指導を行うことが重要です。
1. 筋肉関連の副作用
- 筋肉痛・筋力低下(最も頻度の高い副作用の一つ)
- 横紋筋融解症(重篤だが発生頻度は低い)
横紋筋融解症の発生頻度については大規模研究(N Engl J Med 2002; 346:539-540)によると以下の通りです。
- プラバスタチン(メバロチン):8136万処方で3例(0.000004%)
- ロスバスタチン(クレストール):9919万処方で19例(0.00002%)
- アトルバスタチン(リピトール):1億4036万処方で6例(0.000004%)
2. 肝機能障害
- ALT(GPT)上昇(1-2%程度)
- AST(GOT)上昇
- まれに重篤な肝障害
3. 糖代謝への影響
- 糖尿病発症リスクの軽度上昇(一部のスタチンで報告)
- ピタバスタチンは血糖上昇作用が少ないとされる
4. その他の副作用
- 消化器症状(下痢、胸やけ、吐き気など)
- 頭痛、めまい
- 発疹などのアレルギー反応
- 関節痛
副作用への対応策と注意点
- 相互作用に注意。
- グレープフルーツジュースとの相互作用:特にシンバスタチン(リポバス)とアトルバスタチン(リピトール)でAUCとCmaxが大幅に上昇
- グレープフルーツの小腸CYP3A4阻害は不可逆的で回復に数日かかるため、間隔をあけても影響あり
- フィブラート系薬剤との併用時は特に腎機能に注意
- 患者特性に応じたスタチン選択。
- 肝機能障害患者:水溶性のプラバスタチンが比較的安全
- 糖尿病患者:ピタバスタチンが血糖上昇作用少なく適している
- 薬物相互作用が懸念される場合:CYP代謝を受けにくい製剤を選択
- モニタリング計画。
適切なモニタリングと管理を行うことで、スタチン治療の安全性を高めることができます。副作用のリスク因子を持つ患者(高齢者、腎機能障害患者、甲状腺機能低下症患者など)では、より慎重な観察が必要です。
スタチンの種類と個別化医療:遺伝子多型による効果と副作用予測
スタチン治療においても、近年注目されている個別化医療(precision medicine)のアプローチが研究されています。特に患者の遺伝的背景がスタチンの効果や副作用に影響を与える可能性があり、これを事前に予測することで最適な治療選択が可能になるという考え方です。
遺伝子多型とスタチン効果
スタチンの効果における個人差には、以下の遺伝子多型が関与することが報告されています。
- SLCO1B1遺伝子。
- 肝臓への薬物取り込みトランスポーターをコードする遺伝子
- 多型によりスタチンの血中濃度が上昇し副作用リスクが高まる
- 特に筋肉毒性との関連が強い(c.521T>C多型)
- APOE遺伝子。
- コレステロール代謝に関与するアポリポタンパク質E(ApoE)をコードする遺伝子
- E2、E3、E4などの変異型によりスタチンの効果に差が生じる
- E4保有者はスタチン効果が弱い傾向
- CYP酵素系の遺伝子。
- CYP3A4、CYP2C9などの代謝酵素の遺伝子多型
- 特にシンバスタチン、アトルバスタチンの代謝に影響
これらの遺伝子多型を事前に検査することで、以下のようなメリットが期待されます。
- ハイリスク患者の特定と代替療法の検討
- 個人に最適な薬剤選択と用量調整
- 副作用発現リスクの事前予測と回避
実際に欧米では、SLCO1B1遺伝子の多型検査に基づいてスタチン選択のガイダンスを行う臨床薬理学会のガイドラインも作成されています。
日本人における遺伝子多型の特徴
日本人では、特定のSLCO1B1遺伝子多型の頻度が欧米人と異なることが報告されています。これは人種間でスタチンの効果や副作用感受性に差が生じる可能性を示唆しています。
さらに、HLA型とスタチン関連筋症との関連も報告されており、特定のHLA-DRB1アリルを持つ患者ではスタチンによる免疫反応が生じやすい可能性があります。
しかし、まだ臨床現場で遺伝子検査に基づくスタチン選択が一般化されるには至っていません。今後の研究進展により、より精度の高い個別化治療が実現することが期待されます。
将来展望
今後、次世代シークエンサーなどの技術発展と遺伝子情報のビッグデータ解析により、より包括的な薬剤応答予測モデルが構築される可能性があります。このようなアプローチは、患者ごとに最適なスタチンの種類と用量を選択する「真の個別化医療」を実現する鍵となるでしょう。
また、近年注目されているメタボロミクス解析により、スタチン応答性を予測するバイオマーカーの同定も進んでいます。将来的には遺伝子情報と代謝物情報を統合した総合的なスタチン応答性予測システムが確立されることが期待されます。
スタチンの種類と新規配合剤:治療選択肢の拡大と将来展望
スタチン治療の進化は単剤での改良だけでなく、他の脂質異常症治療薬との組み合わせによる配合剤開発にも見られます。これらの配合剤は患者の服薬負担軽減と治療効果の最大化を目指しています。
現在使用可能な主なスタチン配合剤
- スタチン+エゼチミブ配合剤。
- ロスーゼット(ロスバスタチン+エゼチミブ)
- アトーゼット(アトルバスタチン+エゼチミブ)
- リバゼブ(ピタバスタチン+エゼチミブ)
これらの配合剤は異なる作用機序(肝臓での合成阻害と小腸での吸収阻害)を組み合わせることで、単剤より強力なLDLコレステロール低下効果を実現します。特に動脈硬化性疾患の二次予防や、高リスク患者の一次予防において重要な選択肢となっています。
- スタチン+降圧剤配合剤。
海外で一部使用されているタイプの配合剤で、高脂血症と高血圧を同時に持つ患者に対して検討されています。
スタチン治療の新たなアプローチ
現在の脂質異常症治療には、スタチン療法に関して「Treat to Target」(目標値設定治療)と「Fire and Forget」(初期治療維持)という2つのアプローチがあります。前者は定期的に脂質値を測定して用量調整を行うのに対し、後者は高リスク患者に対して十分量のスタチンを処方し、その後の用量調整をあまり行わないというアプローチです。
専門家の間でもどちらが適切か議論が分かれていますが、日本の診療ガイドラインでは基本的に「Treat to Target」の考え方が採用されています。しかし、近年の大規模研究データに基づき、特に二次予防においては「Fire and Forget」的なアプローチの有効性も認識されつつあります。
今後の開発動向と期待される進展
- 新規スタチン製剤。
現在の6種類に続く第7世代のスタチンとして、より選択性が高く副作用の少ない製剤の開発が試みられています。特に筋肉毒性の低減を目指した研究が進行中です。
- 長時間作用型製剤。
服薬頻度を減らした週1回投与型のスタチン製剤の開発も一部で進められており、服薬アドヒアランスの向上が期待されています。
- 新規配合剤。
スタチンとPCSK9阻害薬(エボロクマブ、アリロクマブなど)の配合剤の開発も視野に入れられています。これらの組み合わせにより、これまで到達できなかったLDL-C値の大幅な低下が可能になると期待されています。
- 個別化治療への発展。
薬力学的バイオマーカーや遺伝子情報を活用した、より精密なスタチン治療の個別化が進むと予測されています。
スタチン治療は、発見から50年近くが経過した現在も脂質異常症治療の中心的役割を担っており、新たな配合剤の登場や治療アプローチの進化により、その重要性は今後も続くと考えられます。特に、動脈硬化性疾患の予防という真の目的を達成するため、より効果的で安全な治療法の開発が期待されています。
【第3類医薬品】ラングロン 100カプセル
