抗体薬物複合体の種類と一覧
抗体薬物複合体の承認薬剤一覧と適応疾患
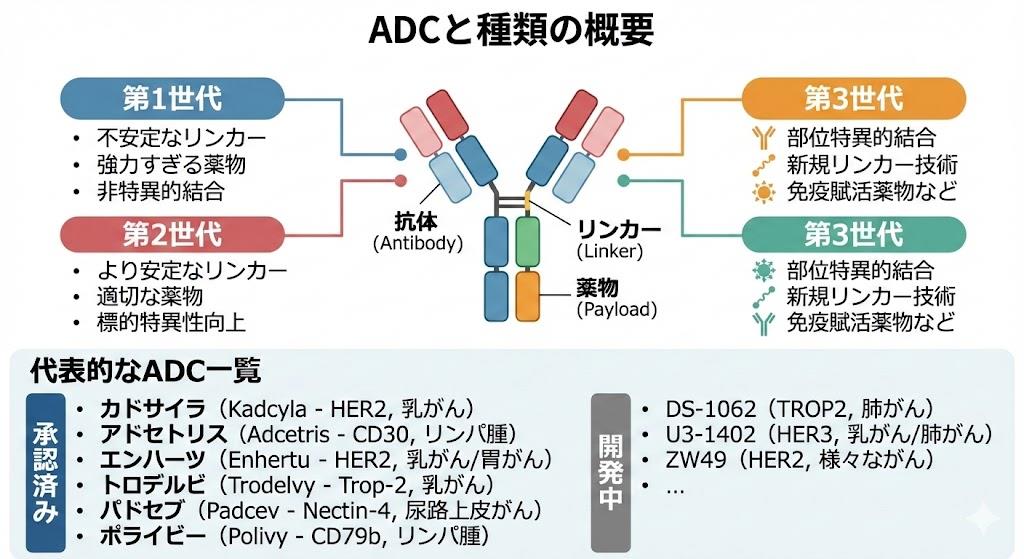
抗体薬物複合体(ADC)は、がん治療における革新的な治療法として、現在日本で10種類以上が承認されています。これらのADCは、特定のがん種や病期に応じて使い分けられており、従来の化学療法では治療困難な症例に対しても効果が期待されています。
血液がんに対するADC一覧
- ゲムツズマブ オゾガマイシン(マイロターグ®)
- 標的抗原:CD33
- 適応:再発または難治性のCD33陽性急性骨髄性白血病
- 薬物:オゾガマイシン
- 承認年:2005年
- ブレンツキシマブ ベドチン(アドセトリス®)
- 標的抗原:CD30
- 適応:ホジキンリンパ腫、末梢性T細胞リンパ腫
- 薬物:モノメチルアウリスタチンE(MMAE)
- 承認年:2014年
- イノツズマブ オゾガマイシン(ベスポンサ®)
- 標的抗原:CD22
- 適応:再発または難治性のCD22陽性急性リンパ性白血病
- 薬物:オゾガマイシン
- 承認年:2018年
- ポラツズマブ ベドチン(ポライビー®)
- 標的抗原:CD79b
- 適応:再発または難治性のびまん性大細胞型B細胞リンパ腫
- 薬物:MMAE
- 承認年:2021年
固形がんに対するADC一覧
- トラスツズマブ エムタンシン(カドサイラ®)
- 標的抗原:HER2
- 適応:HER2陽性乳癌
- 薬物:エムタンシン
- 承認年:2013年
- トラスツズマブ デルクステカン(エンハーツ®)
- 標的抗原:HER2
- 適応:HER2陽性乳癌、HER2陽性胃癌
- 薬物:エキサテカン
- 承認年:2020年
- エンホルツマブ ベドチン(パドセブ®)
- 標的抗原:nectin-4
- 適応:根治切除不能な尿路上皮癌
- 薬物:MMAE
- 承認年:2021年
- セツキシマブ サロタロカン(アキャルックス®)
- 標的抗原:EGFR
- 適応:切除不能な局所進行または局所再発の頭頸部癌
- 薬物:IRDye700DX
- 承認年:2020年
これらのADCは、それぞれ異なる標的抗原を認識することで、特定のがん種に対する選択的な治療効果を発揮します。特に、従来の治療法に抵抗性を示す再発・難治性のがんに対して、新たな治療選択肢を提供しています。
抗体薬物複合体の作用機序と標的分子
ADCの作用機序は、「標的認識」「細胞内取り込み」「薬物放出」「細胞死誘導」の4段階に分けることができます。この精緻なメカニズムにより、健康な細胞への影響を最小限に抑えながら、がん細胞を選択的に攻撃することが可能になります。
第1段階:標的認識と結合
ADCの抗体部分は、がん細胞表面に過剰発現している特定の抗原を認識し、高い親和性で結合します。この標的抗原には以下のようなものがあります。
- HER2(ヒト上皮成長因子受容体2)
- 乳癌の約20-25%、胃癌の約15-20%で過剰発現
- トラスツズマブ系ADCの標的
- CD30(クラスター分化抗原30)
- ホジキンリンパ腫、特定のT細胞リンパ腫で高発現
- ブレンツキシマブ ベドチンの標的
- EGFR(上皮成長因子受容体)
- 多くの固形がんで過剰発現
- セツキシマブ サロタロカンの標的
第2段階:細胞内取り込み(内在化)
抗体が標的抗原に結合すると、受容体介在エンドサイトーシスによりADC全体が細胞内に取り込まれます。この過程では、細胞膜が内側に陥入してエンドソームを形成し、ADCを細胞質内に運搬します。
第3段階:薬物放出
細胞内に取り込まれたADCは、リソソームの酸性環境やプロテアーゼ酵素の作用により、リンカー部分が切断され、細胞毒性薬物が遊離されます。リンカーの種類により放出機序が異なります。
- 酸感受性リンカー:リソソームの低pH環境で切断
- 酵素切断性リンカー:カテプシンBなどのプロテアーゼで切断
- 還元感受性リンカー:細胞内のグルタチオンで切断
第4段階:細胞死誘導
放出された細胞毒性薬物は、DNA合成阻害、微小管機能阻害、DNA損傷などの機序により、がん細胞にアポトーシス(細胞死)を誘導します。代表的な薬物とその作用機序は以下の通りです。
- メルタンシン(DM1):微小管重合阻害
- MMAE:微小管脱重合促進
- エキサテカン:トポイソメラーゼI阻害
- オゾガマイシン:DNA二重鎖切断
抗体薬物複合体の開発動向と臨床試験
ADC開発は急速に進展しており、現在世界中で90種類以上のADCが臨床試験段階にあります。この分野の技術革新は、より効果的で安全性の高い次世代ADCの創出を目指しています。
第一世代から第二世代ADCへの進化
従来の第一世代ADCでは、抗体のリシン残基やシステイン残基を介した非特異的結合により、薬物結合数(DAR:Drug-to-Antibody Ratio)や結合位置が不均一でした。これにより、薬物動態や治療効果にばらつきが生じるという課題がありました。
第二世代ADCでは、以下の技術革新により均一性が改善されています。
- 部位特異的結合技術
- 遺伝子工学的手法による特定部位への薬物結合
- 非天然アミノ酸の導入
- 酵素的結合反応の利用
- 最適化されたリンカー設計
- 血漿中での安定性向上
- 細胞内での効率的な薬物放出
- バイスタンダー効果の制御
新規標的抗原の探索
従来のHER2、CD30以外にも、多様ながん種に対応する新規標的抗原の研究が進んでいます。
- Trop2:トリプルネガティブ乳癌で高発現
- nectin-4:尿路上皮癌で高発現
- BCMA:多発性骨髄腫で特異的発現
- FRα:卵巣癌で高発現
併用療法の開発
ADCの治療効果をさらに高めるため、以下の併用療法が検討されています。
- 免疫チェックポイント阻害剤との併用
- ADCによる腫瘍抗原放出と免疫応答の増強
- PD-1/PD-L1阻害剤との相乗効果
- 従来の化学療法との併用
- 異なる作用機序による相補的効果
- 耐性機序の回避
- 放射線治療との併用
- DNA損傷の相乗的増強
- 腫瘍血管への影響
抗体薬物複合体の副作用と安全性管理
ADCは標的特異性により副作用の軽減が期待される一方で、独特の有害事象プロファイルを示すため、適切な安全性管理が重要です。
ADC特有の副作用分類
標的関連毒性(On-target toxicity)
正常組織における標的抗原の発現により生じる副作用。
- 血小板減少症
- CD33標的ADC(ゲムツズマブ オゾガマイシン)
- 正常造血幹細胞のCD33発現による影響
- 末梢神経障害
- MMAE含有ADC(ブレンツキシマブ ベドチン)
- 軸索輸送の阻害による感覚神経障害
- 間質性肺疾患
- HER2標的ADC(トラスツズマブ デルクステカン)
- 肺組織でのHER2低発現による影響
標的外毒性(Off-target toxicity)
抗体の非特異的分布や薬物の遊離により生じる副作用。
- 肝機能障害
- 肝臓での薬物代謝による肝細胞毒性
- トランスアミナーゼ上昇、ビリルビン上昇
- 消化器毒性
- 悪心、嘔吐、下痢
- 粘膜上皮細胞への非特異的影響
- 血液毒性
- 好中球減少症、貧血
- 骨髄への薬物分布による造血抑制
安全性モニタリング戦略
治療開始前の評価項目
- 標的抗原発現の確認
- 免疫組織化学染色またはFISH法
- 治療効果予測と適応患者選択
- 臓器機能評価
- 心機能(HER2標的ADC)
- 肺機能(間質性肺疾患リスク評価)
- 肝腎機能(薬物代謝・排泄機能)
治療中のモニタリング
- 定期的な血液検査
- 血球数算定(週1-2回)
- 肝機能検査(治療毎)
- 腫瘍マーカー測定
- 画像検査
- 胸部CT(間質性肺疾患スクリーニング)
- 腫瘍効果判定(RECIST criteria)
- 症状モニタリング
- 神経学的検査(末梢神経障害評価)
- 呼吸器症状(咳嗽、呼吸困難)
- 感染症徴候(好中球減少時)
用量調整・休薬基準
Grade 3以上の血液毒性や非血液毒性出現時には、以下の対応が推奨されます。
- 一時休薬:毒性がGrade 1以下に改善するまで
- 用量減量:75%用量から段階的に減量
- 中止基準:肺毒性Grade 2以上、肝毒性Grade 3以上
抗体薬物複合体の将来展望と新規応用分野
ADC技術は、がん治療を超えて多様な疾患領域への応用が期待されており、次世代医療の中核技術として注目されています。
非腫瘍性疾患への応用展開
自己免疫疾患治療への応用
抗体免疫調節薬複合体(iADC)として、関節リウマチなどの自己免疫疾患に対する応用が研究されています。
- ABBV-3373
- グルココルチコイド結合抗体
- 関節リウマチ患者での第IIa相試験で有効性確認
- 全身性副作用の軽減を実現
- 標的細胞選択的免疫抑制
- 炎症部位特異的な薬物送達
- 感染リスクの最小化
- 長期使用における安全性向上
感染症治療への応用
抗体抗生物質複合体(AAC)として、薬剤耐性細菌感染症への新たなアプローチが検討されています。
- 細菌特異的標的化
- 病原菌表面抗原に対する特異的抗体
- 正常細菌叢への影響最小化
- バイオフィルム破壊
- 従来の抗生物質では到達困難な部位への薬物送達
- 慢性感染症の根治的治療
技術革新による次世代ADC
多重標的ADC(Multi-target ADC)
複数の標的抗原を同時に認識するバイスペシフィック抗体を利用したADC。
- 腫瘍異質性への対応
- 単一標的では不十分な症例への適用
- 耐性獲得機序の回避
- T細胞エンゲージャーADC
- がん抗原とT細胞抗原の同時認識
- 免疫細胞活性化と直接的細胞毒性の併用
新規薬物送達システム
- プロドラッグ型ADC
- 細胞内酵素による多段階的薬物活性化
- より高い選択性と安全性
- ナノ粒子結合ADC
- 薬物放出制御の精密化
- 腫瘍組織滞留時間の延長
精密医療への統合
- バイオマーカー指向型治療
- 標的抗原発現レベルに基づく患者選択
- 薬物動態遺伝子多型の考慮
- リアルタイムモニタリング
- 血中循環腫瘍DNA(ctDNA)による治療効果予測
- PET/CTを用いたADC分布イメージング
製造技術の革新
- 連続製造プロセス
- 品質の均一性向上
- 製造コストの削減
- 細胞フリー合成系
- 抗体生産の効率化
- 修飾抗体の簡便な作製
これらの技術革新により、ADCは今後10年間でがん治療の標準的選択肢となるとともに、感染症、自己免疫疾患、神経変性疾患など幅広い疾患領域で革新的治療法を提供することが期待されています。
ADCの将来展望に関する詳細な分析
抗体薬物複合体は、精密医療時代における個別化治療の実現において、中核的な役割を果たす技術として、医療従事者が注目すべき治療選択肢です。各ADCの特徴を理解し、患者の病状や標的抗原発現パターンに応じた適切な選択が、治療成功の鍵となります。
製薬 大リストラ(週刊東洋経済eビジネス新書No.369)
